
Энтропия. Направление протекания химических процессов в изолированных системах. Второе начало термодинамики. Расчет энтропии химической реакции
Date: 2015-10-07; view: 523.
Вопрос 29
Энтальпия реакции - это разность между суммой энтальпий образования продуктов реакции и суммой энтальпий образования реагентов с учетом стехиометрических количеств веществ
Расчет энтальпии реакции.
| ΔH = ∑(nΔH)продукты - ∑(nΔH)реагенты |
Для некоторой реакции
| nAA + nBB = nCC + nDD |
стандартная энтальпия реакции равна:
| ΔH°298 = (nCΔH°298(С) + nDΔH°298(D)) - (nAΔH°298(A) + nBΔH°298(B)) |
Пример. Стандартная энтальпия следующей реакции:
| 4NH3(г) + 5O2(г) = 4NO(г) + 6H2O(г) ΔH°298 = (nNO·ΔH°298(NO) + nH2O·ΔH°298(H2O)) - (nNH3·ΔH°298(NH3) + nO2·ΔH°298(O2)) = = (4·(+91) + 6·(-242)) - (4·(-46) + 5·(0)) = -904 кДж |
Термодинамическая энтропия S, часто просто именуемая энтропия, в химии и термодинамике является функцией состояния термодинамической системы.
Понятие энтропии было впервые введено в 1865 году Рудольфом Клаузиусом. Он определил изменение энтропии термодинамической системы при обратимом процессе как отношение общего количества тепла  к величине абсолютной температуры
к величине абсолютной температуры  :
:
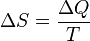 .
.
Например, при температуре 0 °C, вода может находиться в жидком состоянии и при незначительном внешнем воздействии начинает быстро превращаться в лед, выделяя при этом некоторое количество теплоты. При этом температура вещества так и остается 0 °C. Изменяется состояние вещества, сопровождающееся выделением тепла, вследствие изменения структуры.
В изолированной системе самопроизвольно протекают процессы в направлении большего беспорядка или наиболее вероятного существования.
Энтропия – количественная мера беспорядка в системе, чем выше энтропия, тем больше беспорядок.
В изолированной системе самопроизвольно протекают процессы в направлении увеличения энтропии системы
ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ, устанавливает существование энтропии как ф-ции состояния макроскопич. системы и вводит понятие абс. термодинамич. т-ры. Утверждает, что все процессы, протекающие с конечной скоростью, в принципе необратимы, и дает термодинамич. критерии для определения направленности процессов. Вместе с первым началом термодинамики - основа классич., или феноменологич., термодинамики, к-рую можно рассматривать как развитую систему следствий этих двух начал.
| <== previous lecture | | | next lecture ==> |
| Следствия из закона Гесса | | | Изменение энтропии в химических реакциях |